Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hà Nội:
Hóa chất & Thiết bị thí nghiệm KV. Phía Bắc: 0826020020 KV. Phía Nam: 0825250050
Bạn đang tìm kiếm công thức tính pH cho bài tập hóa học hay cần kiểm soát độ pH trong sản xuất, hồ bơi, bể cá? Độ pH là một chỉ số quyền lực, quyết định tính chất của hầu hết dung dịch quanh ta. Trong hướng dẫn toàn diện này, chuyên gia hóa học của VIETCHEM sẽ phân tích tất cả các công thức tính pH từ cơ bản đến nâng cao, kèm theo ví dụ minh họa dễ hiểu và các lưu ý thực tiễn quan trọng mà bạn không thể bỏ qua.

Hiểu một cách đơn giản, pH là chỉ số đo độ axit hay độ kiềm (bazo) của một dung dịch. Về mặt hóa học, pH là một thang đo logarit của nồng độ ion hydro (H⁺) trong dung dịch.
Thang đo pH là một dải số chạy từ 0 đến 14, giúp chúng ta xác định nhanh chóng tính chất của một dung dịch:
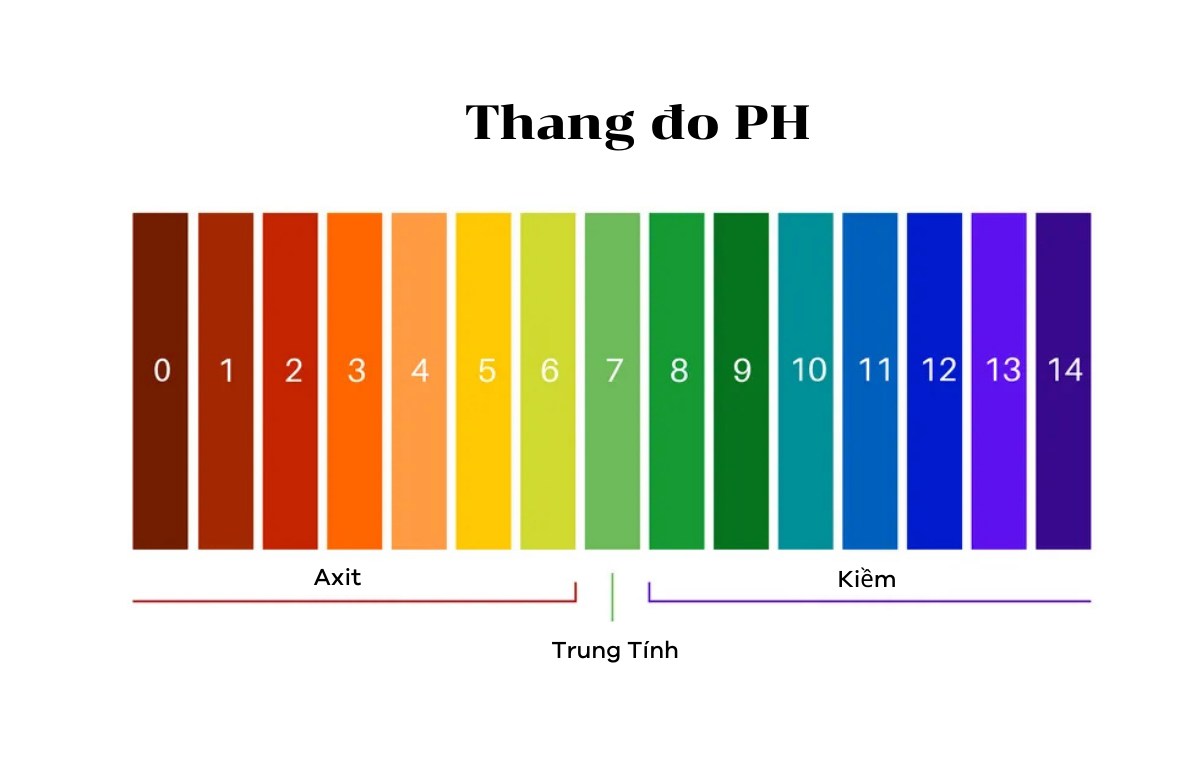
Kiểm soát pH là yếu tố cốt lõi trong vô số lĩnh vực:
Dưới đây là các công thức bạn cần nắm vững, được sắp xếp theo mức độ từ cơ bản đến nâng cao.
Đây là hai công thức nền tảng nhất trong hóa học dung dịch:
pH=−log[H+]
pOH=−log[OH−]
Trong đó:
Mối liên hệ vàng: Ở 25°C, pH và pOH luôn liên kết với nhau qua một hằng số:
pH+pOH=14
Điều này có nghĩa là nếu bạn biết pH, bạn có thể dễ dàng tìm ra pOH và ngược lại.
Axit mạnh và bazo mạnh là các chất điện li mạnh, chúng phân ly hoàn toàn trong nước. Vì vậy, nồng độ ion H⁺ hoặc OH⁻ sẽ bằng chính nồng độ ban đầu của axit hoặc bazo.
Ví dụ: Tính pH của dung dịch HCl 0.01M.
Với Bazo mạnh: [OH⁻] = Cₑ (Cₑ là nồng độ mol của bazo)
Ví dụ: Tính pH của dung dịch NaOH 0.01M.
Vì NaOH là bazơ mạnh, [OH⁻] = 0.01 M = 10⁻² M.
Ta có: pOH = -log(10⁻²) = 2.
Vậy: pH = 14 - pOH = 14 - 2 = 12.

Các phương pháp đo pH
Axit yếu và bazo yếu chỉ phân ly một phần trong nước. Để tính pH, chúng ta cần dùng đến hằng số phân ly axit (Kₐ) hoặc hằng số phân ly bazo (Kₐ).
Dung dịch đệm là dung dịch có khả năng duy trì độ pH gần như không đổi khi thêm một lượng nhỏ axit hoặc bazo. Đây là loại dung dịch cực kỳ quan trọng.
Phương trình Henderson-Hasselbalch:
pH=pKa+log[A−]/[HA]
Trong đó:

Công thức tính pH dung dịch đệm
Tại VIETCHEM, chúng tôi hiểu rằng việc tính toán và kiểm soát pH không chỉ là lý thuyết. Đó là yếu tố quyết định chất lượng sản phẩm và hiệu quả sản xuất. Ví dụ:
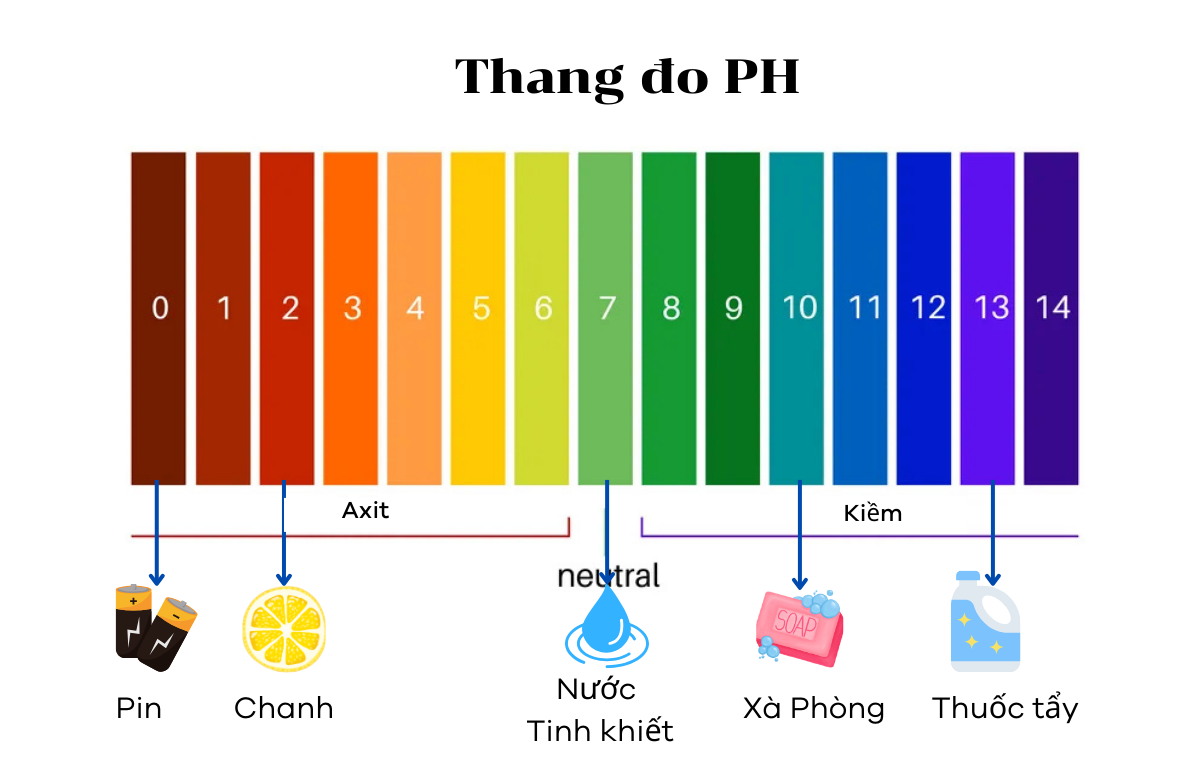
Để dễ hình dung, bạn có thể tham khảo bảng giá trị pH của một số dung dịch quen thuộc trong đời sống.
|
Dung dịch |
Giá trị pH (ước tính) |
|
Axit Ắc quy |
< 1.0 |
|
Dịch vị dạ dày |
1.5 - 3.5 |
|
Nước chanh |
2.4 |
|
Giấm ăn |
2.9 |
|
Cà phê |
5.0 |
|
Sữa tươi |
6.5 |
|
Nước tinh khiết |
7.0 |
|
Máu người |
7.35 - 7.45 |
|
Nước biển |
8.0 |
|
Xà phòng |
9.0 - 10.0 |
|
Amoniac (NH₃) |
11.0 |
|
Thuốc tẩy (Javen) |
12.5 |
|
Xút ăn da (NaOH) |
14.0 |
Sử dụng công thức pH + pOH = 14 (ở 25°C). Nếu bạn có pOH = 3, thì pH = 14 - 3 = 11.
Có hai phương pháp chính:
Nhiệt độ ảnh hưởng đến giá trị pH. Hầu hết các phép tính và thang đo chuẩn đều dựa trên nhiệt độ 25°C. Khi đo lường, cần hiệu chuẩn máy đo pH bằng các dung dịch đệm chuẩn để đảm bảo độ chính xác.
Việc nắm vững các công thức tính pH là kỹ năng thiết yếu cho bất kỳ ai làm việc trong lĩnh vực hóa học, sinh học và các ngành công nghiệp liên quan. Từ những công thức cơ bản đến phương trình Henderson-Hasselbalch phức tạp, mỗi công thức đều mở ra một cánh cửa để hiểu và kiểm soát thế giới hóa học xung quanh chúng ta.
Nếu bạn cần tư vấn về các dung dịch đệm chuẩn, hóa chất công nghiệp, hay các thiết bị đo lường chuyên dụng cho phòng thí nghiệm và nhà máy, hãy liên hệ ngay với VIETCHEM để nhận được giải pháp tối ưu và sự hỗ trợ chuyên nghiệp nhất!
Nguồn tham khảo: Các khái niệm và công thức được đối chiếu với định nghĩa từ Hiệp hội Hóa học Thuần túy và Ứng dụng Quốc tế (IUPAC).
Bài viết liên quan
Sodium Bicarbonate (thường gọi là Baking Soda, thuốc muối hay Na Bicarbonat) không chỉ là một nguyên liệu trong gian bếp mà còn là hợp chất then chốt trong y tế và công nghiệp. Vậy Sodium Bicarbonate là chất gì, có tác dụng gì và tại sao nó lại được coi là "hợp chất đa năng"
0
Trong thế giới khoa học hiện đại, phản ứng hạt nhân không chỉ là một khái niệm vật lý lý thuyết mà còn là trụ cột của ngành năng lượng, y tế và công nghệ vật liệu.
0
Trong vật lý, cơ học và cả hóa học, momen là một đại lượng then chốt dùng để mô tả tác động làm quay của một lực hoặc sự phân bố của một đại lượng vật lý quanh một điểm hoặc trục
0
Melamine là một cái tên đã trở nên quá quen thuộc trong ngành nội thất và đồ gia dụng, nhưng không phải ai cũng thực sự hiểu rõ bản chất của nó. Có người lo ngại về độc tính, có người lại nhầm tưởng đây là tên của một loại gỗ tự nhiên
0

MIỀN BẮC
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN TRUNG
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN NAM
Hóa chất thí nghiệm
0825 250 050
saleadmin808@vietchem.vn

MIỀN NAM
Thiết bị thí nghiệm
0939 154 554
kd201@labvietchem.com.vn

Đinh Phương Thảo
Giám đốc kinh doanh
0963 029 988
sales@hoachat.com.vn

Vũ Thị Thảo
Hóa Chất Công Nghiệp
0948261486
thao.kimex@vietchem.com.vn

Đặng Duy Vũ
Hóa Chất Công Nghiệp
0988 527 897
kd864@vietchem.vn

Hồ THị Hoài Thương
Hóa chất và Thiết bị thí nghiệm
096 7609897
kd801@labvietchem.vn

Thiên Bảo
Hóa Chất Công Nghiệp
0939 702 797
cskh@drtom.vn

Trương Mỷ Ngân
Hóa Chất Công Nghiệp
0901 041 154
cskh@drtom.vn

Phạm Văn Trung
Hóa Chất Công Nghiệp
0918 986 544 0328.522.089
kd805@vietchem.vn

Nguyễn Thị Hương
Hóa Chất Công Nghiệp
0377 609 344 0325.281.066
sales811@vietchem.vn
Gửi bình luận mới
Gửi bình luận