Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hà Nội:
Hóa chất & Thiết bị thí nghiệm KV. Phía Bắc: 0826020020 KV. Phía Nam: 0825250050
Trong hóa học, khi tìm hiểu về tính chất vật lý chắc hẳn chúng ta đều thấy xuất hiện yếu tố độ tan. Hãy cùng VIETCHEM đi tìm hiểu độ tan là gì, công thức tính độ tan và những yếu tố nào sẽ ảnh hưởng đến độ tan của một chất, qua nội dung bài viết dưới đây nhé!
- Độ tan hay độ hòa tan là đại lượng đặc trưng cho khả năng hòa tan của một chất (rắn, lỏng hay khí) vào dung môi để tạo thành một dung dịch đồng nhất. Hay còn được hiểu đó chính là số gam của chất đó hòa tan vào trong 100g dung môi (thường là nước) để tạo ra một dung dịch bão hòa tại một điều kiện nhiệt độ cho trước.

Độ tan là gì?
- Người ta thường dựa vào đặc trưng này để xác định chất đó là chất tan hay không tan:
- Hầu hết các axit đều tan trong nước, ngoại trừ axit silixic (H2SiO3)
- Phần lớn các bazơ không tan trong nước, trừ NaOH, Ba(OH)2, KOH,… và Ca(OH)2 ít tan
- Muối:
- Độ tan được xác định theo công thức:
S = (mct/mdm) x 100
Trong đó:
Ví dụ: Hãy xác định độ tan trong nước của muối Na2CO3 (khi ở 18 độ C). Biết rằng, khi ở nhiệt độ này, nếu hòa tan hết 53g Na2CO3 trong 250g nước thì sẽ thu được dung dịch bão hòa.
Độ tan của muối Na2CO3 là: SNa2CO3 = 53 x 100/ 250 = 21,2g.

Làm thế nào để tính được độ tan của một chất
- Từ công thức trên, chúng ta cũng có thể suy ra được mối quan hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chúng ở một nhiệt độ xác định:
C% = 100 x S/ (100 + S)
Độ tan càng nhỏ tương ứng với chất càng ít tan và ngược lại.
Theo định luật Henry, các chất khí với độ tan nhỏ và áp suất không quá cao thì lượng chất khí hòa tan trong một thể tích chất lỏng xác định sẽ tỷ lệ thuận với áp suất của nó trên một bề mặt chất lỏng ở nhiệt độ không đổi. Vì vậy, nếu tăng áp suất, độ tan của chất khí sẽ được tăng lên và ngược lạ.
Các chất rắn dạng vô định hình sẽ có độ tan lớn hơn so với chất rắn dạng tinh thể. Nguyên nhân là do ở dạng kết tinh có cấu trúc mạng lưới tinh thể tương đối bền vững. Do vậy, nó cần nhiều năng lượng để có thể phá vỡ cấu trúc hơn. Tuy nhiên, chất rắn dưới dạng vô định hình không ổn định như dạng tinh thể và thường có xu hướng chuyển sang dạng tinh thể.
Trong quá trình kết tinh, chất rắn có thể tồn tại dưới dạng khan hoặc ngậm nước. So với dạng ngậm nước, chất rắn ở dạng khan có độ tan lớn hơn.
Tùy vào điều kiện xảy ra kết tinh mà một chất rắn có thể có các dạng tinh thể khác nhau như đồng kết tinh, hydrat,.. cùng với các tính chất vật lý và độ tan trong dung môi là không giống nhau. Đối với những tinh thể kém bền sẽ cần ít năng lượng trong phá vỡ cấu trúc nên dễ tan hơn.
Chất điện ly trong dung dịch có khả năng làm giảm độ tan của các chất tan nên cần lưu ý pha loãng chất điện ly trước khi hòa vào dung dịch.
Khi nồng độ của các ion cùng tên tăng lên, cân bằng điện ly của chất tan sẽ dần chuyển dịch về hướng phân tử ít tan và làm giảm đi độ tan của chất. Vì vậy, để thực hiện việc hòa tan, cần tiến hành với những chất ít tan trước, sau đó mới là các chất dễ tan.
Khi kết hợp các hỗn hợp dung môi đồng tan cùng với nước như glycerin-ethanol-nước thì độ tan của những chất khó tan sẽ tăng lên.
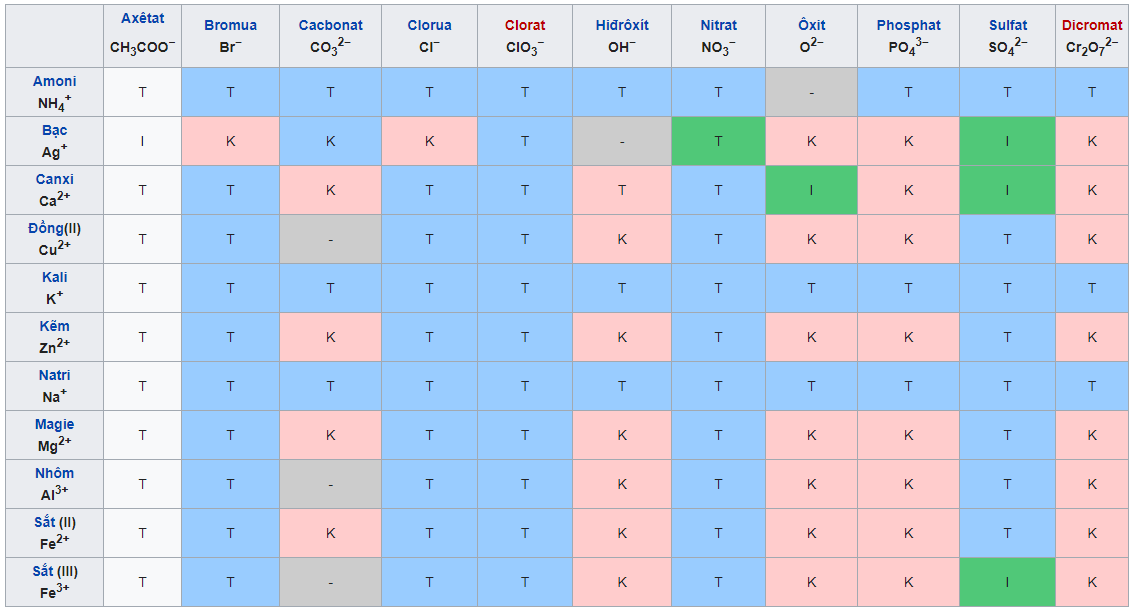
Bảng tính tan của muối, axit, bazơ

Bảng tính tan của hiđro cùng các kim loại
Trong đó:
- Bảng tính tan gồm có các hàng là các anion gốc axit (OH-) và các cột là các cation kim loại. Với tùy từng chất cụ thể, chúng ta sẽ xác định ra ion dương và âm, sau đó dóng theo hàng và cột tương ứng để biết được trạng thái của chất đó tại một ô.
- Có thể tham khảo cách học bảng tính tan thông qua bài thơ như:

Cách nhớ bảng tính tan bằng thơ
Cách ghi nhớ bảng tính tan:
|
Hợp chất |
Tính chất |
Trừ |
|
Axit (xem ở cột ion H+ cùng anion gốc axit tường ứng) |
Tan |
H2SiO3 |
|
Bazơ (xa ở hàng in OH- cùng các cation tương ứng) |
Không tan |
NaOH, KOH, LiOH, Ca(OH)2, NH4OH, Ba(OH)2 |
|
- Muối liti - Muối natri - Muối Kali - Muối amoni |
Tan |
|
|
- Muối bạc |
Không tan (AgCl) |
AgNO3, CH3COOAg |
|
- Muối nitrat - Muối axetat |
Tan |
|
|
- Muối clorua - Muối bromua - Muối iotua |
Tan |
- AgCl: kết tủa trắng - AgBr: kết tủa vàng nhạt - Agl: kết tủa vàng - PbCl2, PbBr2, Pbl2 |
|
- Muối sunfat |
Tan |
- BaSO4, PbSO4, CaSO4: kết tủa trắng - Ag2SO4: ít tan |
|
- Muối sunfit - Muối cacbonat |
Không tan |
Muối của kim loại kiềm cùng amoni NH4+ |
|
- Muối sunfua |
Không tan |
Muối của kim loại kiềm, kiềm thổ cùng amoni NH4+ |
|
- Muối photphat |
Không tan |
Muối, Na+, K+ và amoni NH4+ |
Trên đây là những thông tin cơ bản về độ tan là gì, công thức tính cũng như cách ghi nhớ tính tan đơn giản nhất, hy vọng với bài viết này bạn đọc đã có thêm cho mình những tài liệu tham khảo bổ ích. Liên hệ với VietChem thông qua số hotline 0826 010 010 nếu có bất kỳ thắc mắc nào liên quan nhé.
Bài viết liên quan
Ethyl Acetate Có Độc Không? Nỗi lo của bạn về "độc tính" là hoàn toàn chính đáng. Nhưng trên thực tế, nguy cơ lớn nhất khi sử dụng dung môi Ethyl Acetate không phải là ngộ độc chết người, mà là rủi ro cháy nổ và khả năng gây tổn thương mắt nếu không được bảo vệ.
0
Đây là một trong những câu hỏi quan trọng nhất mà VIETCHEM nhận được từ khách hàng, từ các chủ doanh nghiệp sản xuất đến người tiêu dùng cá nhân. Câu trả lời trực tiếp của chúng tôi, với tư cách là chuyên gia hóa chất, là: "Có, Axeton (Acetone) có độc".
0
Trong thế giới hóa chất công nghiệp và các ứng dụng đời sống, Dung môi IPA (Isopropyl Alcohol), hay còn gọi là Isopropanol, là một trong những hóa chất quen thuộc và đa dụng bậc nhất. Từ vai trò không thể thay thế trong việc tẩy rửa vi mạch điện tử, thành phần cốt lõi của cồn sát khuẩn 70 độ, đến dung môi quan trọng cho ngành sơn và mực in, IPA xuất hiện trong hầu hết mọi lĩnh vực sản xuất và đời sống.
0
Hãy thử nhìn vào bàn tay bạn, chiếc điện thoại bạn đang cầm, hay ngước nhìn những ngôi sao lấp lánh trên bầu trời đêm. Bạn có tin rằng tất cả những gì chúng ta nhìn thấy, chạm vào và cảm nhận được – từ nguyên tử nhỏ nhất đến các thiên hà khổng lồ – chỉ chiếm vỏn vẹn 5% vũ trụ.
0

MIỀN BẮC
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN TRUNG
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN NAM
Hóa chất thí nghiệm
0825 250 050
saleadmin808@vietchem.vn

MIỀN NAM
Thiết bị thí nghiệm
0939 154 554
kd201@labvietchem.com.vn

Đinh Phương Thảo
Giám đốc kinh doanh
0963 029 988
sales@hoachat.com.vn

Vũ Thị Thảo
Hóa Chất Công Nghiệp
0948261486
thao.kimex@vietchem.com.vn

Đặng Lý Nhân
Hóa Chất Công Nghiệp
0971 780 680
sales259@vietchem.vn

Lê Thị Mộng Vương
Hóa Chất Công Nghiệp
0964 674 897
kd867@vietchem.vn

Thiên Bảo
Hóa Chất Công Nghiệp
0939 702 797
cskh@drtom.vn

Trương Mỷ Ngân
Hóa Chất Công Nghiệp
0901 041 154
cskh@drtom.vn

Phạm Văn Trung
Hóa Chất Công Nghiệp
0918 986 544 0328.522.089
kd805@vietchem.vn

Nguyễn Thị Hương
Hóa Chất Công Nghiệp
0377 609 344 0325.281.066
sales811@vietchem.vn
Gửi bình luận mới
Gửi bình luận