Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hóa chất công nghiệp KV. Hà Nội: 0963029988 KV. TP.HCM: 0826050050
Hà Nội:
Hóa chất & Thiết bị thí nghiệm KV. Phía Bắc: 0826020020 KV. Phía Nam: 0825250050
Phản ứng giữa SO₂ + NaOH là một trong những phản ứng kinh điển và quan trọng bậc nhất trong hóa học vô cơ và ứng dụng công nghiệp. Nó không chỉ là kiến thức nền tảng trong sách giáo khoa mà còn là chìa khóa cho nhiều quy trình xử lý môi trường và sản xuất hóa chất quy mô lớn. Bài viết này, dưới góc nhìn của một chuyên gia 20 năm kinh nghiệm từ VietChem, sẽ đi sâu vào bản chất, cách cân bằng phương trình và những ứng dụng thực tiễn không thể bỏ qua của phản ứng này.

Tùy thuộc vào tỷ lệ số mol giữa NaOH và SO2, chúng ta có hai trường hợp phản ứng chính:
Trường hợp 1: Tỷ lệ mol nSO2/nNaOH≥2
Khi NaOH dư hoặc tỷ lệ mol đạt từ 2 trở lên, phản ứng tạo ra muối trung hòa là natri sunfit (Na2SO3).
SO2 + 2NaOH → Na2SO3 + H2O
Trường hợp 2: Tỷ lệ mol nSO2 / nNaOH ≤ 1
Khi SO2 dư hoặc tỷ lệ mol bằng 1, phản ứng tạo ra muối axit là natri bisunfit (NaHSO3).
SO2 + NaOH→ NaHSO3
Bảng so sánh 2 trường hợp phản ứng
|
Tỷ lệ mol (T=nSO2/nNaOH) |
Phương trình phản ứng |
Sản phẩm chính |
Tên gọi sản phẩm |
|
T ≤ 1 |
SO2 + NaOH → NaHSO3 |
Muối axit |
Natri bisunfit (natri hiđrosunfit) |
|
1 < T < 2 |
Xảy ra cả 2 phản ứng |
Hỗn hợp 2 muối |
NaHSO3 và Na2SO3 |
|
T ≥ 2 |
SO2 + 2NaOH → Na2SO3 + H2O |
Muối trung hòa |
Natri sunfit |
Theo lý thuyết axit-bazơ Arrhenius, cơ chế phản ứng có thể được giải thích như sau:
Nói một cách đơn giản, đây là một cuộc "kéo co" giữa axit và bazơ. Nếu bazơ mạnh và nhiều (tỷ lệ ≥2), nó sẽ "trung hòa" hoàn toàn axit, tạo ra muối trung hòa Na2SO3. Nếu bazơ không đủ mạnh hoặc không đủ nhiều (tỷ lệ ≤1), nó chỉ có thể "trung hòa" một phần, tạo ra muối axit NaHSO3.
Về bản chất, đây là phản ứng trung hòa giữa một oxit axit (lưu huỳnh đioxit - SO2) và một bazơ mạnh (natri hiđroxit - NaOH). Khi khí SO2 sục vào dung dịch NaOH, chúng sẽ tác dụng với nhau để tạo ra muối và nước.
Điểm đặc biệt của phản ứng này là sản phẩm tạo thành (muối natri sunfit Na2SO3 hay natri bisunfit NaHSO3) phụ thuộc hoàn toàn vào tỷ lệ mol giữa SO2 và NaOH. Chính đặc tính này đã mở ra nhiều ứng dụng thực tiễn, nổi bật nhất là trong công nghệ xử lý khí thải SO2 từ các nhà máy công nghiệp và sản xuất các hóa chất phái sinh.
Để hiểu rõ phản ứng, trước hết chúng ta cần nắm vững bản chất của hai "nhân vật" chính.
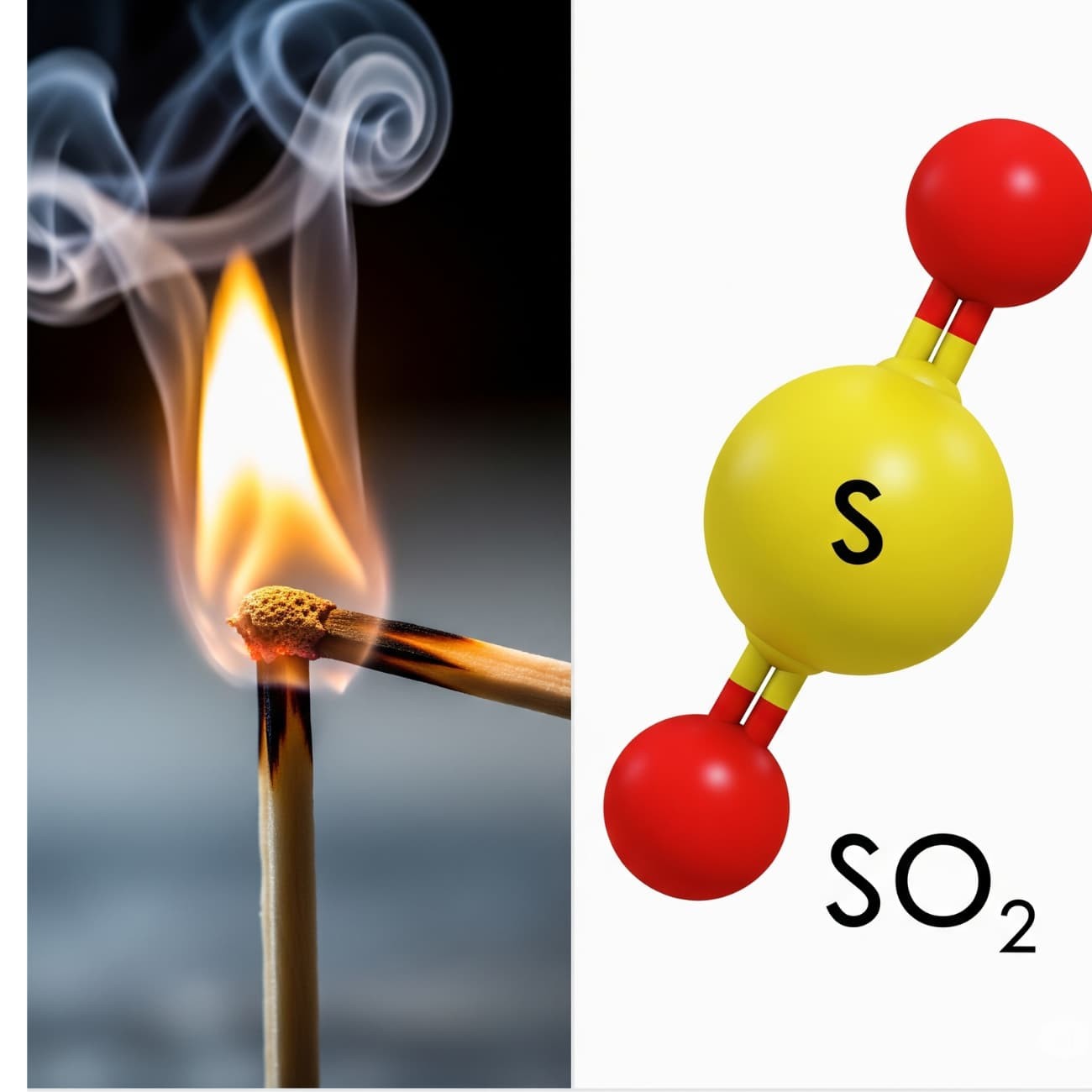
SO2 là gì? Đây là một oxit axit, tồn tại ở dạng khí không màu, có mùi hắc đặc trưng (mùi que diêm cháy). Khí này tan trong nước tạo thành dung dịch axit sunfurơ (H2SO3), một axit yếu và không bền.
SO2 + H2O ⇌ H2SO3
Ngoài tính axit, SO2 còn thể hiện cả tính khử (khi tác dụng với chất oxi hóa mạnh như KMnO4,Br2) và tính oxi hóa (khi tác dụng với chất khử mạnh như H2S).
Tính chất hóa học của SO₂
Bảng tóm tắt tính chất của SO₂
|
Thuộc tính |
Chi tiết |
|
Trạng thái |
Khí không màu, mùi hắc |
|
Khối lượng mol |
≈64.07 g/mol |
|
Độ tan trong nước |
9.4 g/100 mL ở 25°C (tan tốt, tạo axit) |
|
Tính chất hóa học chính |
Oxit axit, tính khử, tính oxi hóa |
|
Độc tính |
Độc, gây kích ứng đường hô hấp |
NaOH là gì? Thường được biết đến với tên gọi xút ăn da, NaOH là một trong những bazơ mạnh nhất. Nó tồn tại ở dạng rắn (vảy, viên, hạt), màu trắng, có tính hút ẩm cực mạnh (dễ chảy rữa khi để ngoài không khí) và tỏa nhiệt lớn khi hòa tan trong nước.
NaOH có khả năng ăn mòn da, giấy, và nhiều kim loại (như nhôm, kẽm), do đó cần hết sức cẩn trọng khi sử dụng. Nó là hóa chất nền tảng trong rất nhiều ngành công nghiệp như sản xuất giấy, xà phòng, dệt nhuộm và xử lý nước.

Xút Vảy NaOH
Bảng tóm tắt tính chất của NaOH
|
Thuộc tính |
Chi tiết |
|
Trạng thái |
Rắn (vảy, viên, hạt), màu trắng |
|
Khối lượng mol |
≈40.00 g/mol |
|
Độ tan trong nước |
109 g/100 mL ở 20°C (tan rất tốt, tỏa nhiệt mạnh) |
|
Tính chất hóa học chính |
Bazơ mạnh, hút ẩm mạnh, tính ăn mòn cao |
|
Ứng dụng chính |
Ngành sản xuất xà phòng, giấy, tơ tổng hợp kết hợp với công tác xử lý nước |
Đây được xem là ứng dụng then chốt. Khí SO2 sinh ra từ việc đốt nhiên liệu hóa thạch (than đá, dầu mỏ) trong các nhà máy nhiệt điện, luyện kim là nguyên nhân chính gây mưa axit. Để xử lý, người ta sử dụng các tháp hấp thụ (scrubber) chứa dung dịch NaOH.
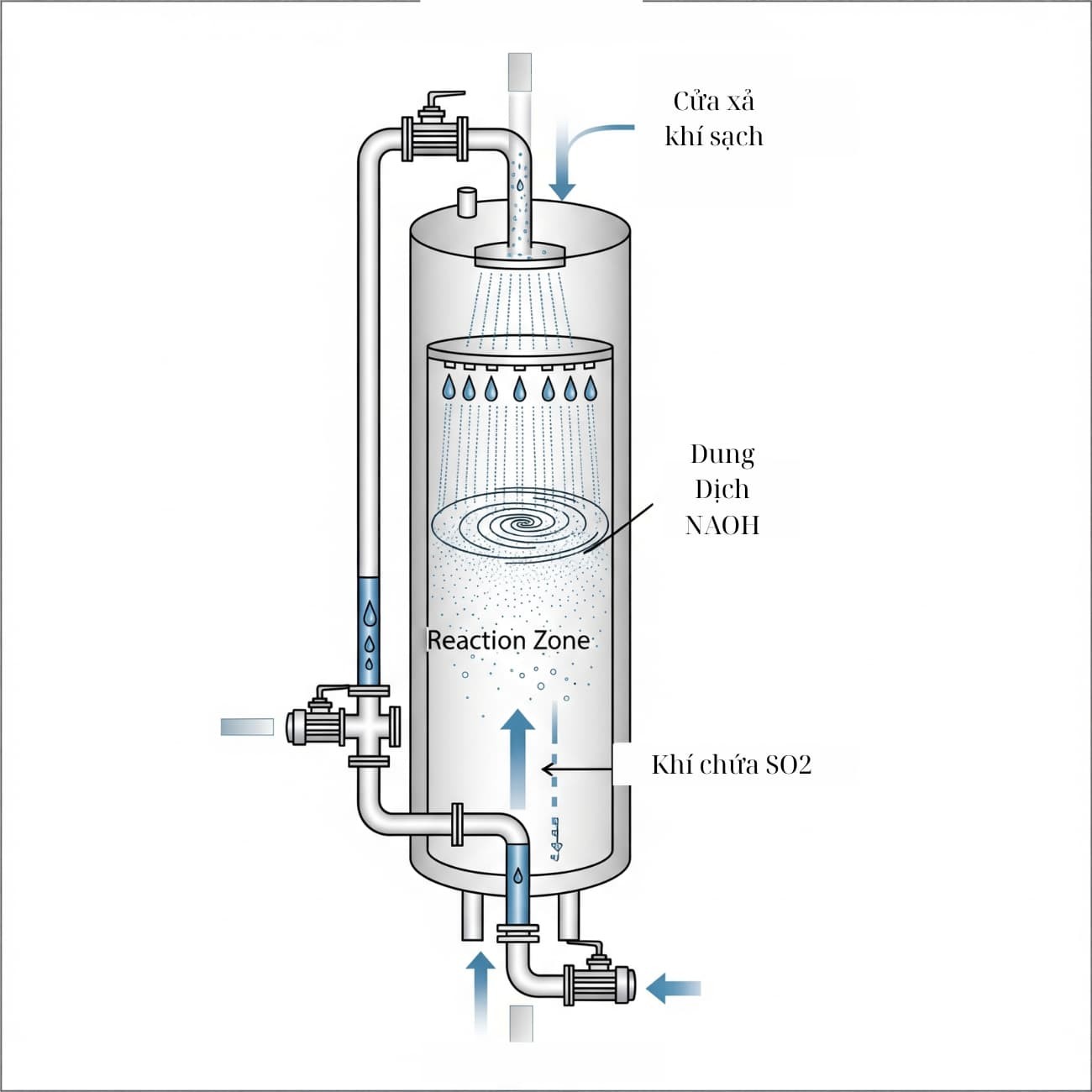
Ứng dụng phản ứng SO₂ + NaOH trong xử lý khí thải SO₂ trong công nghiệp
Bài tập 1 (Tính toán): Sục 4,48 lít khí SO2 (đktc) vào dung dịch chứa 20 gam NaOH. Tính khối lượng muối thu được.
Bài tập 2 (Cân bằng nâng cao): Cho biết sản phẩm tạo thành khi sục từ từ V lít khí SO2 vào dung dịch chứa a mol NaOH.
Phản ứng SO2+NaOH không chỉ đơn thuần là một phương trình hóa học. Nó là minh chứng cho sự gắn kết chặt chẽ giữa khoa học lý thuyết và các ứng dụng thực tiễn, từ bảo vệ môi trường đến sản xuất công nghiệp. Việc hiểu sâu sắc về nó giúp chúng ta tối ưu hóa quy trình và tạo ra những sản phẩm giá trị.
Để đảm bảo thành công cho các ứng dụng của bạn, VietChem luôn sẵn sàng là đối tác tin cậy, cung cấp NaOH và các hóa chất liên quan với chất lượng và dịch vụ tốt nhất thị trường.
>>> Xem thêm  :
:
Nhiên liệu là gì? Gồm loại nào? Vai trò trong đời sống?
Axit clohydric HCl là gì? Các phương pháp điều chế và sản xuất axit clohydric
Bài viết liên quan
Sodium Bicarbonate (thường gọi là Baking Soda, thuốc muối hay Na Bicarbonat) không chỉ là một nguyên liệu trong gian bếp mà còn là hợp chất then chốt trong y tế và công nghiệp. Vậy Sodium Bicarbonate là chất gì, có tác dụng gì và tại sao nó lại được coi là "hợp chất đa năng"
0
Trong thế giới khoa học hiện đại, phản ứng hạt nhân không chỉ là một khái niệm vật lý lý thuyết mà còn là trụ cột của ngành năng lượng, y tế và công nghệ vật liệu.
0
Trong vật lý, cơ học và cả hóa học, momen là một đại lượng then chốt dùng để mô tả tác động làm quay của một lực hoặc sự phân bố của một đại lượng vật lý quanh một điểm hoặc trục
0
Melamine là một cái tên đã trở nên quá quen thuộc trong ngành nội thất và đồ gia dụng, nhưng không phải ai cũng thực sự hiểu rõ bản chất của nó. Có người lo ngại về độc tính, có người lại nhầm tưởng đây là tên của một loại gỗ tự nhiên
0

MIỀN BẮC
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN TRUNG
Hóa chất & Thiết bị thí nghiệm
0826 020 020
sales@labvietchem.com.vn

MIỀN NAM
Hóa chất thí nghiệm
0825 250 050
saleadmin808@vietchem.vn

MIỀN NAM
Thiết bị thí nghiệm
0939 154 554
kd201@labvietchem.com.vn

Đinh Phương Thảo
Giám đốc kinh doanh
0963 029 988
sales@hoachat.com.vn

Nguyễn Viết Hải
Hóa Chất Công Nghiệp
0865 181 855
viethai@vietchem.vn

Đặng Duy Vũ
Hóa Chất Công Nghiệp
0988 527 897
kd864@vietchem.vn

Hồ THị Hoài Thương
Hóa chất và Thiết bị thí nghiệm
096 7609897
kd801@labvietchem.vn

Trần Sĩ Khoa
Hóa Chất Công Nghiệp
0888 851 648
cskh@drtom.vn

Mai Văn Đền
Hóa Chất Công Nghiệp
0888 337 431
cskh@drtom.vn

Phạm Văn Trung
Hóa Chất Công Nghiệp
0918 986 544 0328.522.089
kd805@vietchem.vn

Nguyễn Thị Hương
Hóa Chất Công Nghiệp
0377 609 344 0325.281.066
sales811@vietchem.vn
Gửi bình luận mới
Gửi bình luận